A termodinâmica é uma área da Física que estuda as
transferências de energia. Busca compreender as relações entre calor, energia e
trabalho, analisando quantidades de calor trocadas e os trabalhos realizados em
um processo físico.
A ciência termodinâmica foi inicialmente desenvolvida por pesquisadores
que buscavam uma forma de aprimorar as máquinas, no período da Revolução
Industrial, melhorando sua eficiência.
Esses conhecimentos se aplicam atualmente em várias situações do nosso
cotidiano. Por exemplo: máquinas térmicas e refrigeradores, motores de carros e
processos de transformação de minérios e derivados do petróleo.
As leis fundamentais da termodinâmica regem o modo como o calor se
transforma em trabalho e vice-versa.
Primeira
Lei da Termodinâmica
A Primeira Lei da Termodinâmica se
relaciona com o princípio da conservação da energia. Isso quer dizer que a
energia em um sistema não pode ser destruída nem criada, somente transformada.
Quando
uma pessoa usa uma bomba para encher um objeto inflável, ela está usando força
para colocar ar dentro do objeto. Isso significa que a energia cinética faz o
pistão abaixar. No entanto, parte dessa energia se transforma em calor, que é
perdida para o meio.
Ela também pode ser encontrada da seguinte forma:
ΔU = Q - W
Onde,
ΔU: variação da
energia interna=> ΔU = Ufinal - Uinicial
Q: calor
W: trabalho
Q: calor
W: trabalho
O fundamento resulta no mesmo: a variação da energia interna (ΔU)
resulta do calor trocado com o meio externo menos o trabalho (W) realizado.
Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor era U=100J, qual será esta energia após o recebimento?
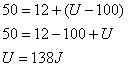
Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor era U=100J, qual será esta energia após o recebimento?
Para usarmos essa fórmula,
precisamos nos atentar para algumas regras de sinais:
·
ΔU – será
positivo, se a temperatura do sistema aumentar;
·
ΔU – será
negativo, se a temperatura do sistema diminuir;
·
Q – será
positivo, se o sistema absorver calor do meio externo;
·
Q – será
negativo, se o sistema ceder calor ao meio externo;
·
τ – será
positivo, se o sistema se expandir, realizando trabalho sobre o meio externo;
·
τ – será
negativo, se o sistema se contrair, recebendo trabalho do meio externo.
Variação da energia interna
O termo ΔU
refere-se à mudança de energia atribuída à energia cinética das
partículas constituintes do sistema, no caso de um gás ideal, pode-se dizer que
ΔU equivale a:

n – número de mols (mol)
R – constante universal dos gases ideais (0,082 atm.l/mol.K ou
8,31 J/mol.K)
T – temperatura absoluta (kelvin)
Analisando
as fórmulas, pode-se perceber que, caso não ocorra uma mudança de temperatura
no sistema, sua energia interna também
permanecerá inalterada. Além disso, é importante dizer que para as máquinas
térmicas, que operam em ciclos, a variação da energia
interna, ao final de cada ciclo, deve ser nula, pois nesse
ponto, o motor volta a operar com a temperatura inicial.
Exercícios
1)
O trabalho realizado em um ciclo térmico fechado é igual a 100 J
e, o calor envolvido nas trocas térmicas é igual a 1000 J e 900 J,
respectivamente, com fontes quente e fria. A partir da Primeira Lei da
Termodinâmica, qual a variação da energia interna nesse ciclo térmico, em
joules? Q = T + ΔU
2)
Um motor só poderá realizar trabalho se receber uma quantidade de
energia de outro sistema. No caso, a energia armazenada no combustível é, em
parte, liberada durante a combustão para que o aparelho possa funcionar. Quando
o motor funciona, parte da energia convertida ou transformada na combustão não
pode ser utilizada para a realização de trabalho. Isso significa dizer que há
vazamento da energia em outra forma. Carvalho, A. X. Z.
De acordo com o texto, as transformações de energia que ocorrem durante
o funcionamento do motor são decorrentes de a
a) liberação de calor dentro do motor ser impossível.
b) realização de trabalho pelo motor ser incontrolável.
c) conversão integral de calor em trabalho ser impossível.
d) transformação de energia térmica em cinética ser impossível.
e) utilização de energia potencial do combustível ser incontrolável.
a) liberação de calor dentro do motor ser impossível.
b) realização de trabalho pelo motor ser incontrolável.
c) conversão integral de calor em trabalho ser impossível.
d) transformação de energia térmica em cinética ser impossível.
e) utilização de energia potencial do combustível ser incontrolável.
3) - Um
cilindro com êmbolo móvel contém um gás à pressão de 4,0.104N/m2. Quando é fornecido 6 kJ de calor ao sistema, à pressão
constante, o volume do gás sofre expansão de 1,0.10-1m3. Determine o trabalho realizado e a variação da energia
interna nessa situação.
Dados:
P = 4,0.104 N/m2
Q = 6KJ
ou 6000 J
ΔV =
1,0.10-1 m3
T = ?
ΔU =
?
1ª
Etapa: Calcular o trabalho com os dados do problema. T = P. ΔV
2ª
Etapa: Calcular a variação da energia interna com o novo dado.
Q = T + ΔU => ΔU= Q – T.

Nenhum comentário:
Postar um comentário