1º C e
B - Química - Período da Atividade;: 13/07
à 17/07*
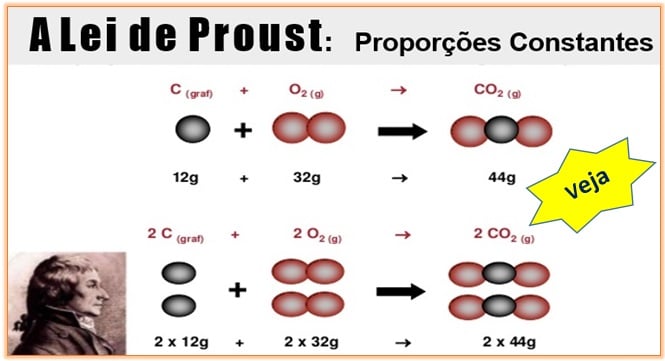
Lei de Proust ou Lei das Proporções Constantes
A Lei de Proust, também
denominada Lei das Proporções Constantes ou Definidas, foi criada pelo químico
francês Joseph Louis Proust (1754-1826) e diz que uma determinada substância
composta é formada por substâncias mais simples, unidas sempre na mesma proporção
em massa.
O químico francês Joseph Louis Proust (1754-1826) passou a
realizar cuidadosas experiências relacionando as massas dos componentes de
determinadas reações.
Por exemplo, os elementos que compõem a água são o hidrogênio e o oxigênio. Proust verificou que nessa reação de formação da água, o hidrogênio sempre reagia com o oxigênio em uma proporção constante e definida, que era de 1:8, respectivamente. Veja como isso ocorre abaixo:
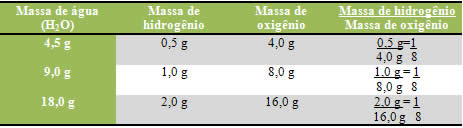
.
Observe que não importa a quantidade de massa dos elementos usada, a proporção sempre será a mesma.
Proust observou que isso não ocorria somente com a água, mas com todas as outras substâncias.
São formados 15,06 g de sulfeto cúprico (CuS), por exemplo, reagindo 10,00 g de cobre metálico (Cu) com 5,06 g de enxofre (S). Assim, se dobrarmos a quantidade de cobre (que irá para 20,0 g), e se quisermos que todo o cobre reaja, será necessário dobrar também a quantidade do enxofre, para 10,12 g, com a formação total de 30,12 g de sulfeto.
Agora, se for colocada uma quantidade que não esteja em proporção, a quantidade em excesso irá sobrar, não irá reagir. Observe isso a seguir:
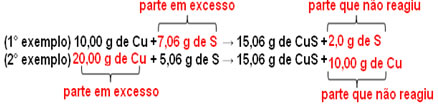
Observe que a reação só ocorre de acordo com a proporção definida. Por isso, em 1799, Proust concluiu que, quando várias substâncias se combinam para formar um composto, isso é sempre feito numa relação de massas definida.
Assim, ele criou uma Lei que é denominada de Lei de Proust, Lei das Proporções Constantes ou Lei das Proporções Definidas, que é enunciada da seguinte maneira:

Essa lei e a Lei de Lavoisier (Lei da Conservação da Massa) são denominadas Leis Ponderais, porque falam em massas das substâncias envolvidas.
Veja agora um exemplo sobre a Lei de
Proust
 Nitrogênio + Hidrogênio
Amônia
Nitrogênio + Hidrogênio
Amônia

Veja agora um exemplo sobre a Lei de
Proust
Sabe-se que 28 g de nitrogênio reagem completamente com 6 g de
hidrogênio, formando amônia. Qual será a massa, em gramas de amônia formada,
quando 140 g de nitrogênio reagir com hidrogênio suficiente para completar a
reação?
Resolução:
Utilizando a Lei de Lavoisier, sabemos que a massa dos produtos é igual
à soma das massas dos reagentes, assim, temos:
28g + 6g x
Agora utilizaremos a Lei de Proust, que nos diz que a
proporção das massas dos reagentes e dos produtos deve ser mantida constante.
Assim, se a massa do nitrogênio passou de 28 g para 140 g, quer dizer que ela
aumentou 5 vezes, por isso, as outras massas também terão que aumentar 5 vezes:
Portanto a massa da amônia formada nesse caso é 170 g.
Exercício
1)
46,0 g de sódio reagem com 32,0 goxigênio formando
peróxido de sódio. Quantos gramas de sódio serão necessários para obter 156 g
de peróxido de sódio?
2)
A reação de combustão
do etanol (C2H6O) produz gás carbônico (CO2) e
água (H2O). Calcule as massas X, Y e Z por meio dos dados fornecidos
a seguir:
C2H6O + 3 O2 →
2 CO2 + 3 H2O
Massa do C2H6O
|
Massa do O2
|
Massa do
CO2
|
Massa do H2O
|
46 g
|
96 g
|
88 g
|
54 g
|
9,2 g
|
X
|
Y
|
Z
|
3)
Encontre os
valores de A e B na reação de síntese do óxido de magnésio a partir de magnésio
metálico e gás oxigênio. Para tal, utilize os dados fornecidos pela tabela a
seguir:
2 Mg + O2 → 2 MgO
Massa de Mg
|
Massa de O2
|
Massa de MgO
|
48 g
|
32 g
|
80 g
|
96 g
|
A
|
B
|
4)
Observe as massas das substâncias envolvidas nas experiências químicas
abaixo e analise se elas estão de acordo com a Lei de Proust:
1.
Experiência 1: 2g de hidrogênio são
combinados com 8g de oxigênio
2.
3. Experiência 2:
1,25g de hidrogênio são combinados com 5g de oxigênio
Obs.: A massa atômica é o valor que aparece logo abaixo dos nomes de cada elemento na tabela periódica.
Obs.: A massa atômica é o valor que aparece logo abaixo dos nomes de cada elemento na tabela periódica.

Nenhum comentário:
Postar um comentário