Camada de Valência
A Camada de Valência é a última camada de distribuição eletrônica de um átomo. Por ser a camada mais externa, também é a que fica mais distante do núcleo atômico.
De acordo com a Regra do Octeto, a camada de valência precisa de oito elétrons para se estabilizar.
Assim, os átomos adquirem estabilidade quando têm 8 elétrons na camada de valência. Isso acontece com os gases nobres, eles apresentam a camada de valência completa. A única exceção é o elemento Hélio que possui 2 elétrons.
Os demais elementos precisam fazer ligações químicas para receber os elétrons faltantes e alcançar os oito elétrons na camada de valência.
Os elétrons da camada de valência são os que participam das ligações, pois são os mais externos.
Camadas da Eletrosfera
Conforme o modelo atômico de Rutherford-Bohr, os elétrons giram ao redor do núcleo atômico, em diferentes camadas energéticas.
Existem sete camadas designadas pelas letras K, L ,M, N, O, P e Q. Cada uma suporta um número máximo de elétrons.
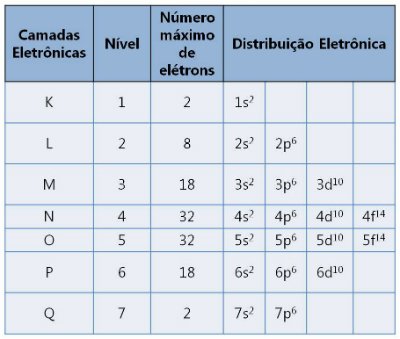 Camadas eletrônicas e os números de elétrons que suportam
Camadas eletrônicas e os números de elétrons que suportamComo determinar a Camada de Valência?
A camada de valência pode ser determinada de duas formas: Distribuição Eletrônica e Tabela Periódica.
Distribuição Eletrônica
Para determinação da camada de valência através da distribuição eletrônica é usado o Diagrama de Linus Pauling.
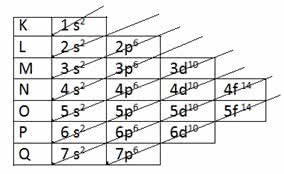 Diagrama de Pauling
Diagrama de Pauling
Lembre-se que o diagrama de Pauling segue a ordem crescente de energia. A última camada obtida na distribuição eletrônica é a camada de valência.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Assim, na camada de valência, o subnivel mais energético é a última camada.
Exemplos:
Nitrogênio - N
Número Atômico: 7
Distribuição eletrônica: 1s2 2s2 2p3
Camada de Valência: 2s2 2p3, o N possui 5 elétrons na camada de valência.
Distribuição eletrônica: 1s2 2s2 2p3
Camada de Valência: 2s2 2p3, o N possui 5 elétrons na camada de valência.
Ferro - Fe
Número Atômico: 26
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Camada de Valência: 4s2, o Fe possui 2 elétrons na camada de valência.
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Camada de Valência: 4s2, o Fe possui 2 elétrons na camada de valência.
Cloro - Cl
Número Atômico: 17
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p5
Camada de Valência: 3s2 3p5, o Cl possui 7 elétrons na camada de valência.
Distribuição eletrônica: 1s2 2s2 2p6 3s2 3p5
Camada de Valência: 3s2 3p5, o Cl possui 7 elétrons na camada de valência.
Oxigênio - O
Número atômico: 8
Distribuição eletrônica: 1s2 2s2 2p4
Camada de Valência: 2s2 2p4, o oxigênio possui 6 elétrons na camada de valência.
Distribuição eletrônica: 1s2 2s2 2p4
Camada de Valência: 2s2 2p4, o oxigênio possui 6 elétrons na camada de valência.
Carbono - C
Número atômico: 6
Distribuição eletrônica: 1s2 2s2 2p2
Camada de Valência: 2s2 2p2, o carbono possui 4 elétrons na camada de valência.
Distribuição eletrônica: 1s2 2s2 2p2
Camada de Valência: 2s2 2p2, o carbono possui 4 elétrons na camada de valência.
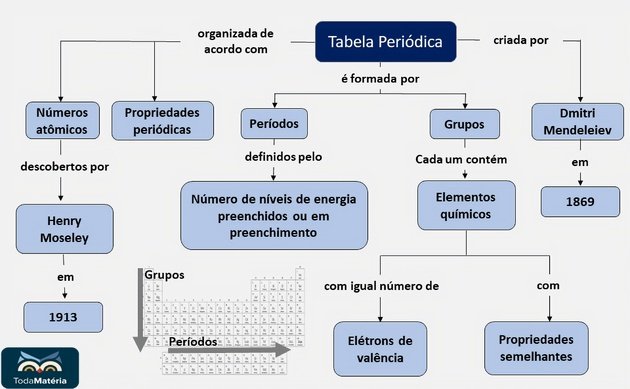
Tabela Periódica
A Tabela Periódica é um modelo que agrupa todos os elementos químicos conhecidos e suas propriedades. Eles estão organizados em ordem crescente de números atômicos (número de prótons).
No total, a nova Tabela Periódica possui 118 elementos químicos (92 naturais e 26 artificiais).
Cada quadrado especifica o nome do elemento químico, seu símbolo e seu número atômico
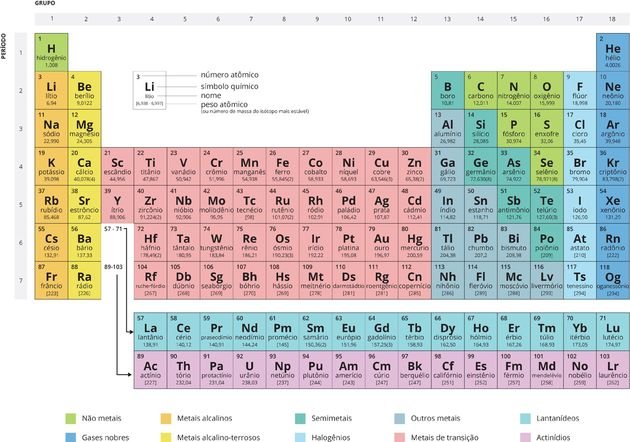
Organização da Tabela Periódica
Os chamados Períodos são as linhas horizontais numeradas, que possuem elementos que apresentam o mesmo número de camadas eletrônicas, totalizando sete períodos.
- 1º Período: 2 elementos
- 2º Período: 8 elementos
- 3º Período: 8 elementos
- 4º Período: 18 elementos
- 5º Período: 18 elementos
- 6º Período: 32 elementos
- 7º Período: 32 elementos
Com a organização dos períodos da tabela algumas linhas horizontais se tornariam muito extensas, por isso é comum representar a série dos lantanídeos e a série dos actinídios à parte dos demais.
As Famílias ou Grupos são as colunas verticais, onde os elementos possuem o mesmo número de elétrons na camada mais externa, ou seja, na camada de valência. Muitos elementos destes grupos estão relacionados de acordo com suas propriedades químicas.
São dezoito Grupos (A e B), sendo que as famílias mais conhecidas são do Grupo A, também chamados de elementos representativos:
- Família 1A: Metais Alcalinos (lítio, sódio, potássio, rubídio, césio e frâncio).
- Família 2A: Metais Alcalino-Terrosos (berílio, magnésio, cálcio, estrôncio, bário e rádio).
- Família 3A: Família do Boro (boro, alumínio, gálio, índio, tálio e unúntrio).
- Família 4A: Família do Carbono (carbono, silício, germânio, estanho, chumbo e fleróvio).
- Família 5A: Família do Nitrogênio (nitrogênio, fósforo, arsênio, antimônio, bismuto e ununpêntio).
- Família 6A: Calcogênios (oxigênio, enxofre, selênio, telúrio, polônio, livermório).
- Família 7A: Halogênios (flúor, cloro, bromo, iodo, astato e ununséptio).
- Família 8A: Gases Nobres (hélio, neônio, argônio, criptônio, xenônio, radônio e ununóctio).
Os elementos de transição, também chamados de metais de transição, representam as 8 famílias do Grupo B:
- Família 1B: cobre, prata, ouro e roentgênio.
- Família 2B: zinco, cádmio, mercúrio e copernício.
- Família 3B: escândio, ítrio e sério de lantanídeos (15 elementos) e actinídeos (15 elementos).
- Família 4B: titânio, zircônio, háfnio e rutherfórdio.
- Família 5B: vanádio, nióbio, tântalo e dúbnio.
- Família 6B: cromo, molibdênio, tungstênio e seabórgio.
- Família 7B: manganês, tecnécio, rênio e bóhrio.
- Família 8B: ferro, rutênio, ósmio, hássio, cobalto, ródio, irídio, meitnério, níquel, paládio, platina, darmstádio.
Por determinação da União Internacional de Química Pura e Aplicada (IUPAC), os grupos passaram a ser organizados por números de 1 a 18, embora ainda seja comum encontrarmos as famílias sendo descritas por letras e números como mostrado anteriormente.
Uma importante diferença que o novo sistema apresentado pela IUPAC gerou é que a família 8B corresponde aos grupos 8, 9 e 10 na tabela periódica.
Exercícios
1. Encontre a camada de valência dos seguintes elementos:
a) Bromo
b) Alumínio
2. (UFSC) O número de elétrons em cada subnível do átomo estrôncio (38Sr) em ordem crescente de energia é:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s
3.(CESGRANRIO) Fazendo a associação entre as colunas abaixo, que correspondem às famílias de elementos segundo a tabela periódica, a sequência numérica será:
| 1. Gases nobres | • Grupo 1A |
| 2. Metais alcalinos | • Grupo 2A |
| 3. Metais alcalinoterrosos | • Grupo 6A |
| 4. Calcogênios | • Grupo 7A |
| 5. Halogênios | • Grupo 0 |
a) 1, 2, 3, 4, 5.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
b) 2, 3, 4, 5, 1.
c) 3, 2, 5, 4, 1.
d) 3, 2, 4, 5, 1.
e) 5, 2, 4, 3, 1.
Nenhum comentário:
Postar um comentário