Habilidade:
Reconhecer a evolução histórica do modelo de calor, a unificação entre trabalho mecânico e calor e o princípio de conservação da energia;
Conteúdo:
Energia Mecânica e Quantidade de calor
Veja os vídeos, leia os textos e realize a atividade 1 do caderno do aluno 2, páginas 31, 32 e 33 e envie pelo email professora.abud@gmail.com
- Quando dois objetos são postos em contato e em movimento com sentidos contrários, entre suas superfícies há atrito. Este atrito faz com que a energia mecânica que está sendo utilizada pelos objetos para se movimentarem não se conserve, pois está sendo transformada em energia térmica (calor) e sonora. Isto implica a não conservação da energia mecânica. Pois o atrito é a energia que está sendo utilizada para a formação e o rompimento de ligações químicas nas regiões de contato entre as duas superfícies dos objetos. Quando o corpo é friccionado um sobre o outro, a ruptura dessas ligações químicas libera calor. Essas ligacões se refazem continuamente em outros pontos de contato, enquanto ocorre o deslocamento relativo entre os objetos.
Atrito, em física, é a força de contato que atua sempre que dois corpos entram em choque e há tendência ao movimento. ... A força de atrito é sempre paralela às superfícies em interação e geralmente contrária ao movimento relativo entre elas.
ENERGIA MECÂNICA
Resultante da soma entre a energia cinética e potencial
A energia mecânica é a soma da energia cinética com a energia potencial. Nessa soma percebe-se a conservação durante o movimento sob ação exclusiva de forças conservativas, como por exemplo, na mecânica, a força peso e a força elástica. Sistemas físicos que se encontram sob essa situação são definidos como sistemas conservativos.
Como exemplo, imagine uma caneta caindo. Ela tem, a cada instante, energia cinética decorrente da sua velocidade e energia potencial gravitacional decorrente da altura em relação ao referencial adotado. Se, por acaso, a caneta estivesse presa a um corpo elástico, poderia-se afirmar ainda que haveria também energia potencial elástica. Portanto, todas as formas de energia são fundamentais para a sobrevivência dos seres vivos.
Pode-se concluir, então, que esse tipo de energia está ligado à Mecânica, ramo da Física que estuda o estado de movimentos dos corpos. Essa área é dividida em cinemática, estática e dinâmica. A unidade de energia, no Sistema Internacional de Unidades (SI), recebe o nome de joule e é simbolizada pela letra J.
Forças dissipativas
Em um sistema de forças não-conservativas, há variação da energia mecânica total. A força de atrito faz um objeto parar, transformando sua energia cinética inicial em calor e som.
Sempre que houver força de atrito, parte da energia mecânica do sistema vai ser transformada em calor e som. É possível verificar isso quando um carro freia bruscamente: escuta-se o som característico da freada e percebe-se a fumaça dos pneus queimando em virtude do aumento da temperatura devido à força de atrito com o asfalto.
Quando um sistema apresenta forças dissipativas, como a força de resistência do ar, a força de atrito, a força viscosa de líquidos, ocorre a diminuição da energia mecânica, com a transformação, principalmente, em energia térmica.
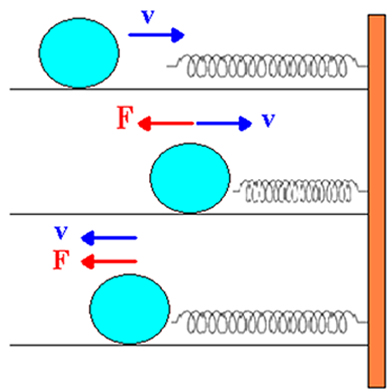
Vejamos a figura acima: nela temos uma bola de massa m com velocidade v indo em direção à mola em repouso. Vemos também que a interação massa/mola faz com que a bola perca velocidade sob a ação da força elástica que a mola exerce sobre ela. Durante a distensão da mola, a velocidade da bolinha vai aumentando em módulo. Vemos que inicialmente o sistema possui apenas energia cinética, em virtude do movimento da bolinha. Porém, quando se inicia a compressão da mola, a energia cinética da esfera diminui até zerar.
Conforme a energia cinética diminui, outra forma de energia surge. Para que seja verdadeiro o princípio da conservação da energia mecânica, essa nova energia provinda da compressão da mola é denominada energia potencial elástica.
Mas quando consideramos condições não ideais, podemos dizer que parte dessa energia mecânica se perde em razão do atrito da bolinha e da compressão irregular da mola. Dessa forma, vemos que as quantidades de energia cinética e potencial não são constantes. Verifica-se ainda que essa energia perdida não pode ser recuperada, ou seja, não volta a compor a energia mecânica total. Por essa razão, ela é denominada energia dissipada.
Se levarmos em conta essa parcela de energia não recuperável, o princípio da conservação da energia continuaria válido: a parcela da energia mecânica (cinética e potencial) que falta considera-se perdida (energia dissipada) por causa das condições não ideais, o que fecha o balanço energético.
O princípio da conservação da energia pode ser de grande utilidade para explicar diversos fenômenos. Mas sabemos que esse princípio aplica-se somente a fenômenos mecânicos, em condições ideais. Temos que nos atentar ao fato de que, em condições ideais, a energia cinética é toda transformada em energia potencial e vice-versa. Mas sabemos que em condições reais isso não ocorre, pois a energia dissipada, em razão do atrito, não mais pode ser recuperada.
Na maioria das máquinas, parte da energia é perdida através do aquecimento, em função do atrito entre suas engrenagens. Se pensarmos na matéria como um conjunto de átomos, esse aquecimento corresponde a um aumento na vibração das moléculas das peças que estão em contato umas com as outras, ou seja, há um aumento na energia cinética das moléculas.
A energia cinética do movimento desordenado das moléculas denomina-se energia térmica. Portanto, dizemos que esse aquecimento acontece pela transformação de algum tipo de energia em energia térmica: a energia foi absorvida pelas moléculas, que agora estão mais agitadas.
No caderno do aluno tem a explicação do experimento de joule e para usá-lo, precisamos relembrar o que é calor específico.
Calor específico é a quantidade de calor necessária para que cada grama de uma substância sofra uma variação de temperatura correspondente a 1°C. Essa grandeza é uma característica de cada tipo de substância e indica o comportamento do material quando exposto a uma fonte de calor.
A tabela a seguir indica o calor específico de algumas substâncias
Aplicações
No estudo da Calorimetria, o calor específico está presente na definição matemática do calor sensível e da capacidade térmica de um material. Alguns fenômenos cotidianos podem ser mais bem compreendidos a partir da definição de calor específico.
Observe na tabela anterior que o calor específico da areia é cinco vezes menor que o da água. Enquanto cada grama de areia precisa de apenas 0,2 cal para variar a sua temperatura em 1°C, a água precisa de 1 cal para executar a mesma tarefa. Compreendemos aqui a razão pela qual durante o dia a areia da praia apresenta-se em uma temperatura superior à da água.
O calor específico não indica a quantidade de calor necessária para que cada grama ou mol de uma substância aumente a sua temperatura em 1°C, mas indica o calor necessário para a variação de 1 °C. Isso significa que pode ocorrer tanto aumento quanto diminuição da temperatura do corpo. Na tabela acima, o ouro é o material de menor calor específico, o que significa que esse material é extremamente sensível às variações de temperatura. Para aquecer ou esfriar determinada quantidade de ouro, é necessária pouca quantidade de energia recebida ou cedida.
A quantidade de calor que gera variação de temperatura é chamada de sensível, e aquela que gera mudança de estado físico é chamada de latente.
O calor pode ser definido como a quantidade de energia que é trocada entre dois corpos em virtude da diferença de temperatura existente entre eles. Essa energia sempre flui do corpo de maior para o de menor temperatura até que o equilíbrio térmico seja atingido, isto é, as temperaturas dos corpos sejam iguais.
Na imagem a seguir, o corpo A possui inicialmente temperatura maior que a do corpo B (TA > TB), por isso, o calor passa de A para B.
Tipos de calor
Dependendo do que ocorre com um corpo qualquer ao receber calor, essa grandeza poderá ser denominada de calor sensível ou latente.
→ Calor sensível: Quantidade de calor que é retirada ou fornecida a um corpo e é capaz apenas de gerar variação de temperatura. A determinação da quantidade de calor sensível é feita pela equação a seguir:

- QS = Quantidade de calor sensível;
- m = Massa da substância aquecida ou resfriada;
- c = Calor específico da substância, isto é, a grandeza que determina a quantidade de calor necessária para que 1 g da substância eleve a sua temperatura em 1°C;Para calcular o calor específico das substâncias utiliza-se a seguinte fórmula:c = Q/m. Δθ ou c = C/mOnde,c: calor específico (cal/g.°C ou J/Kg.K)Q: quantidade de calor (cal ou J)m: massa (g ou Kg)Δθ: variação de temperatura (°C ou K)C: capacidade térmica (cal/°C ou J/K)
- Δt = Variação de temperatura.
→ Calor latente: Quantidade de calor que é fornecida ou retirada de um corpo e gera mudança de estado físico. Para que o calor seja denominado de latente, é necessário que o corpo esteja na temperatura exata da mudança de estado físico. A determinação da quantidade de calor latente é dada pela equação abaixo:
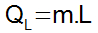
- QL = Quantidade de calor latente;
- m = Massa da substância aquecida ou resfriada;
- L = Calor latente da substância, isto é, grandeza que determina a quantidade de calor necessária para que 1 g da substância mude o seu estado físico.
Existe um comportamento característico das substâncias quando estão em aquecimento. Para entendermos isso, imagine uma determinada quantidade de gelo a uma temperatura inicial de -10°C. Ao iniciar o aquecimento, todo o calor fornecido é utilizado pela substância para elevar a sua temperatura e atingir o ponto de fusão (0°C).
Nesse processo, o calor fornecido é do tipo sensível. Ao atingir o ponto de fusão, a transformação de gelo em água é iniciada. Agora o calor recebido deixa de ser utilizado para o aquecimento do corpo e passa a ser usado para a mudança de fase. Durante esse processo, o calor é chamado de latente e a temperatura do elemento é mantida constante. Caso semelhante ocorre quando a água atinge o ponto de ebulição.




.jpg)
Nenhum comentário:
Postar um comentário